인공유방 보형물을 이식받고 희귀암에 걸린 사례가 국내에서 처음 확인됐다. 해당 제품은 미국 엘러간사의 ‘내트럴’ 모델이다.
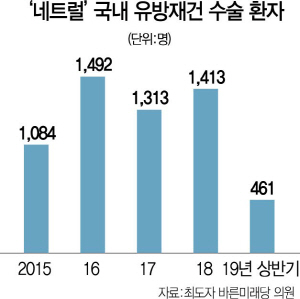
내트럴 보형물은 발암 가능성이 제기돼 미국에서는 이미 리콜 권고조치를 받은 제품으로 국내에서 11만7,787개가 유통·시술된 상태다. 다른 회사 인공보형물까지 포함하면 지난해까지 국내에 이미 21만3,000여개가 유통된 것으로 파악된다. 이에 따라 해당 시술을 받은 환자들에 대한 적극적인 보호조치와 문제 제품에 대한 보건당국의 사후 유통관리가 부실했다는 비판이 거세지고 있다. 보건당국은 엘러간을 비롯해 국내에 인공유방 보형물을 공급하는 6개사 제품에 대한 전수조사를 검토하고 있다.
16일 식품의약품안전처와 대한성형외과학회는 국내에서 유방 보형물을 이식받은 후 희귀암인 역형성 대세포 림프종(BIA-ALCL)에 걸린 환자가 보고됐다고 밝혔다. 해당 암은 면역체계와 관련된 암으로서 발병 시 장액종으로 가슴이 붓는 등 크기 변화가 나타나거나 피막에 발생한 덩어리, 피부 발진 등의 증상을 동반한다. 이번에 보고된 발암 환자는 40대 여성으로 약 7~8년 전 유방 보형물을 삽입하는 확대술을 받았다. 최근 한쪽 가슴이 심하게 부어 이달 6일 성형외과를 방문했다가 역형성 대세포 림프종 의심 소견으로 대학병원에 의뢰돼 이달 13일 진단받았다.
앞서 해외에서는 유방 보형물을 이식받고 역형성 대세포 림프종에 걸린 사례가 293건(미국 152건·호주 82건·프랑스 59건)이나 보고됐고 그중 11명은 사망했다. 이에 따라 프랑스와 캐나다 등 선진국 보건당국은 4월 환자 안전을 위한 사전예방조치로 엘러간의 내트럴 판매를 전격 중단했다. 특히 프랑스국립의약품건강제품안전청(ANSM)은 엘러간 제품뿐 아니라 아리온·세빈·나고르·유로실리콘·폴리텍 등 나머지 거친 표면 유방 보형물 제조사의 제품 판매를 일제히 중단했다. 이번에 문제가 된 엘러간의 유방 보형물은 표면이 거칠어 신체 부착이 잘 되고 수술 후에도 모양이 자연스러워 큰 인기를 끌었다. 그러나 10여년 만에 역형성 대세포 림프종이 발생할 수 있다는 문제점이 드러나 파장이 걷잡을 수 없이 커질 것으로 전망된다.
반면 우리 보건당국은 아직 문제 제품을 이식받은 시술환자 통계조차 확인하지 못하고 있으며 해외에서 문제가 터져 엘러간 측이 스스로 리콜하겠다고 보고한 뒤에야 지난달 “리콜 회수계획을 보고하라”며 뒤늦은 대처에 나섰다. 그나마 엘러간 한국법인(한국엘러간)의 자체 리콜은 지난달 24일 미국 식품의약국(FDA)이 엘러간이 만든 ‘거친 표면 유방 보형물’이 다른 제조사와 비교해 역형성 대세포 림프종 유발 가능성이 6배 높다며 제품 회수를 요청한 후에야 시작됐다. 식약처 관계자는 이에 대해 “문제가 된 보형물은 추적관리대상 의료기기여서 유통에 대한 기록 자체는 확보하고 있으며 유통된 의료기관까지도 추적 가능하다”며 “다만 시술환자 수의 경우 1인당 보형물을 1개 이상 사용할 수도 있고 다양한 경우가 있기 때문에 아직 정확한 통계를 내지 못한 것일 뿐”이라고 해명했다. 아울러 “국내에 유통 중인 유방 보형물 제품은 모두 6개 회사(1곳은 국내 생산품)에서 공급하고 있는데 이번에 문제가 된 엘러간 제품뿐 아니라 6개 회사 전체를 대상으로 (유방 보형물 이식자의) 암을 비롯한 부작용 발생 여부를 조사하는 방안을 검토하고 있다”고 덧붙였다. 대한성형외과학회는 갑작스러운 유방 모양의 변화나 덩어리, 피부 발진 등 의심 증상이 발생하는 경우 반드시 전문 의료기관을 방문하라고 권장했다. 다만 성형외과학회는 미국과 유럽연합(EU) 등 선진국에서도 역형성 대세포 림프종 발생 위험이 낮고, 제거 수술 관련 마취, 수술 후 혈종, 염증, 감염 등 위험성을 고려할 때 증상이 없는 환자가 예방적으로 보형물을 제거하는 것은 권장하지 않고 있다고 덧붙였다.
문제는 유방 보형물 이외의 다른 보형물에 대한 불안감도 확산될 수 있다는 점이다. 코·엉덩이를 비롯한 다양한 신체 부위에 손실된 부위 복원이나 미용 등의 측면에서 광범위하게 이식 시술이 이뤄지고 있는데 부작용에 대해 제대로 추적관리가 되고 있지 않기 때문이다. 이번 유방보형물의 경우도 희귀암 발병사례만 학회를 통해 보고됐을 뿐 그 밖의 다른 일반암 등에 대한 발병 여부에 대해서는 전혀 파악된 자료가 없다고 보건 당국자는 전했다.
이런 가운데 현재 식약처는 한국엘러간과 부작용 발생으로 인한 치료비 등 보상 논의를 진행하고 있지만 구체적인 가닥은 잡히지 않은 상태다. 일각에서는 보건당국이 수입·제조업체에 안전성과 보상대책에 관한 정보를 의존할 것이 아니라 시술환자에 대한 장기추적조사 등 환자 안전관리를 위한 최대한의 대책을 내놓아야 한다고 지적하고 있다. 식약처 관계자는 “수입·제조업체 측에 피해보상대책을 강력하게 요구할 예정”이라며 “유방 보형물의 부작용 조사를 위한 환자 등록연구를 이달부터 시행하는 등 환자 안전관리에 만전을 기할 것”이라고 말했다.
/박홍용기자 prodigy@sedaily.com
< 저작권자 ⓒ 서울경제, 무단 전재 및 재배포 금지 >









 prodigy@sedaily.com
prodigy@sedaily.com









































